Главная
страница
Сведения об авторах
РАЗРАБОТКА МЕТОДА СНИЖЕНИЯ СОДЕРЖАНИЯ СОЕДИНЕНИЙ Zn В ОБОРОТНОМ ЦИКЛЕ ГАЗООЧИСТОК ДОМЕННОГО ЦЕХА ММК имени ИЛЬИЧА
Касимов А. М.,
Александров А. Н., Леонова О. Е.,
Украинский
научно-исследовательский институт
экологических проблем, Харьков,
Украина
Романовский А. А., Национальный
технический университет
«Харьковский политехнический
институт», Харьков, Украина
Климанчук В. В., Ирха В. Н.,
Мариупольский металлургический
комбинат имени Ильича, Мариуполь,
Донецкая область, Украина
Проблема снижения
содержания соединений Zn в
оборотной воде систем газоочисток
доменного производства
Мариупольского металлургического
комбината имени Ильича (ММК имени
Ильича) возникла в связи с
необходимостью его извлечения
из-за нарушений работы всей системы
газоочистки. Соединения Zn,
выходящие с пылегазовой смесью из
печей, оседают в газоходах, вызывая
их зарастание. Наличие cоединений
цинка в отходящих газах связано с
относительно высоким его
содержанием в сырье
металлургического производства.
Для поддержания работоспособности
газоочисток требуется проведение
работ по очистке газоходов от
отложений соединений Zn с
остановкой газоочистного
оборудования. Извлечение
соединений Zn из оборотной воды
рассматривается как метод
предотвращения отложений и
перспективный способ получения
ценного сырья.
Оборотная вода газоочисток
содержит высокие концентрации Zn
из-за явления растворимости даже
труднорастворимых его соединений.
Это связано с тем, что оксид и
другие соединения Zn, содержащиеся в
отходящих газах, частично
растворимы при наличии в оборотной
воде растворенных газов кислотного
характера — СО2 и SO2,
способствующих повышению их
растворимости за счет образования
смешанных комплексов.
В качестве возможных путей
выделения соединений Zn из
оборотной воды были рассмотрены
такие варианты: осаждение,
упаривание и концентрирование
соединений Zn, ионный обмен,
флотация малорастворимых
соединений, экстракция комплексных
соединений.
Упаривание или электрохимическое
выделение Zn при низких
концентрациях (менее 1 г/дм3)
слишком энергоемки. Для ионного
обмена требуется дорогостоящее
оборудование, создание системы
элюации Zn с регенерацией ионита и
вторичной обработкой элюата с
выделением соединений Zn, для
флотации и экстракции требуются
редкие и дорогие реагенты,
стоимость которых оправдана лишь в
случае выделения редких и
драгоценных металлов.
Это делает указанные пути
нерентабельными и технологически
малоперспективными для извлечения
Zn. Реальны только осадительные
методы, которые достаточно дешевы.
Для выделения ионов Zn в виде осадка
можно использовать ряд реагентов.
Их выбор определяется низкой
растворимостью продуктов реакции и
отсутствием комплексообразования
с имеющимися акваионами Zn или
цинкат-ионами. В табл. 1 приведены
сведения о растворимости отдельных
малорастворимых соединений Zn,
пригодных для его выделения из
растворов (по литературным данным).
Таблица 1
Растворимость некоторых соединений цинка
Соединение |
Показатель произведения растворимости |
Растворимость |
Примечания |
| Zn2[Fe(CN)6] | 15,4 |
||
| ZnC2O4 | 8,9 | Образует комплексы | |
| ZnCO3 | 10,0 10,84 10,6 (25оС) |
0,001 г/100 г (15оС) |
|
| Zn(CN)2 | 12,59 | 5.10-4 % (18оС) | Образует очень прочные комплексы |
| Zn(IO3)2.2H2O | 5,4 | 0,86 г/100 г 0,877г/100 г |
|
| Zn3(PO4)2 | 32,0 | Образует комплексы | |
| ZnS | 23,8 | 6,8.10-5 %
(18оС) 3,4.10-11 г/100г (18оС) |
ZnS-альфа 6,9.10-26 ZnS-бета 1,1.10-24 (25оС) |
| ZnO | 1,6.10-4 г/100 г | ||
| Zn(OН)2 | 16,4 | 1,9.10-4 % (29оС) | Образует гидроксокомплексы при pH > 8,2 |
Примечание. Данные о растворимости приведены для 20°С. При отсутствии стандартных данных в скобках указаны иные температурные условия.
Некоторые
противоречия в значениях (табл. 1)
вызваны сложностью экспериментов,
в которых даже при использовании
особо чистых реагентов условия
осаждения и конкурирующие ионы
оказывают существенное влияние на
результаты. В реальных условиях
осаждения отклонения
растворимости от табличных
значений еще выше. Тем не менее эти
данные позволяют оценить
эффективность различных ионов как
осадителей Zn.
Произведение растворимости
используется вместо произведения
активности для малорастворимых
соединений вследствие
невозможности точного определения
ионов в реальных растворах,
обладающих определенной ионной
силой. Произведение растворимости
для малорастворимых веществ
является величиной постоянной, и в
случае, когда активность веществ в
разбавленном растворе стремится к
1, величина произведения
растворимости стремится к значению
произведения активности.
Большая часть соединений Zn, имеющих
низкую растворимость, не может быть
использована на практике по
экологическим (цианиды, сульфиды)
или экономическим (иодаты,
ферри-цианиды) соображениям. В
соответствии с табл. 1 в качестве
осадителей рассмотрены
гид-роксиды, карбонаты. Существует
перспективный осадитель для
двухвалентных ионов — силикат-ион.
Точных данных о растворимости
силикатов Zn нет: все они
оцениваются в литературе как
«нерастворимые». В качестве
реагентов-осадителей можно
использовать ряд доступных
технических продуктов — Na2SiO3
(натрий кремнекислый,
силикат-глыба), в т. ч. растворимый
(ГОСТ 50418-2003), силикат-глыба (ТУ
5921-002-00287645-97, ОСТ 11-027.802-81), Na2Si03
растворимый (ГОСТ 13079-93), стекло
натриевое жидкое (ГОСТ 13078-81).
Фосфаты и пирофосфаты Zn
малорастворимы, но использование
их противопоказано, т. к. из-за
локального образования сложных
смешанных комплексов в
неравновесных реальных условиях в
присутствии этих осадителей и
имеющихся в растворе гидроксо-,
аква-, гидрокарбонат- или
гидросульфит-, хлорид- и других
ионов возможно формирование
нежелательных растворимых
комплексов Zn (табл. 2).
Таблица 2
Константы комплексообразования некоторых соединений цинка при Т=18°С
Лиганд |
lgКуст(1-n) |
| Гидроксил-ион | 6; 11; 13; 14 |
| Пирофосфат | 8,7; 11,0 |
| Гиропирофосфат | 3,8 |
| Сульфат | 2,34 |
| Моногидрофосфат | 2,4 |
| Хлорид | -0,19; 0,18; -1,4; -1,52 |
| Оксалат | 4,85; 7,55; 8,34 |
Произведение растворимости чистого гидроксида Zn в воде составляет 10-11, но на самом деле гидроксид заметно более растворим, чем можно ожидать на основании этой константы, вследствие равновесия
Zn(OH)2 (тв) = Zn(OH)2 (aq), К= 10-6
Из-за наличия в
отходящих газах растворимых
кислотных оксидов — СО2 и SO2,
оксидов азота, а также повышенной
температуры воды в системе
растворимость соединений Zn может
существенно увеличиться.
Образцы проб оборотной воды
представляют собой жидкость с
содержанием небольшого количества
грубой взвеси, легко выпадающей в
осадок. В образцах содержится
0,14—13,0 мг/дм3 растворенных
соединений Zn в пересчете на металл.
После процесса очистки оборотная
вода имеет рН = 6,5—7,0. При движении
ее в оборотном цикле и отстаивании
рН среды меняется, достигая 6,9—8,1.
Это связано с удалением СО2 и
SO2. В выделяющемся осадке
содержится до 30,6% цинка в пересчете
на металл. Количество его
непостоянно и составляет 0,1—2 г/дм3.
Отстаивание этой фракции
малорастворимых соединений
происходит на имеющемся
оборудовании в действующей системе
газоочистки комбината.
Для выделения Zn из растворенных
форм использованы
реагенты-осадители (дешевые и
экологически приемлемые): Na2CO3,
Ca(OH)2, Na2SiO3 («жидкое
стекло»). Первый эксперимент
показал, что раствор Н2СО3,
полученный путем барботирования СО2
через образцы оборотной воды, не
вызывает осаждения карбонатов Zn.
Это связано с подкислением
раствора и образованием
комплексных соединений Zn. Другой
эксперимент показал, что, несмотря
на нейтрализацию кислых
растворенных газов с помощью Na2CO3
или Ca(OH)2, осаждения
соединений Zn также не происходит.
По-видимому, создаваемая в
оборотной воде при газоочистке
концентрация карбонат-и
сульфит-ионов достаточна, чтобы
препятствовать выпадению
соединений Zn в осадок даже в
щелочной среде — до рН = 10. Более
того, чрезмерно щелочная среда
неблагоприятна для осаждения
гидроксидных и карбонатных
соединений Zn, т. к. растворимость их
растет уже при значениях рН > 8,5—9,0
из-за выраженных амфотерных
свойств Zn.
Таким образом, из доступных
осадителей только Na2SiO3
или К2SiO3 и смешанные
растворы силикат-глыбы марки АСКН-1
(калиево-натриевая) и АСНК-1
(натриево-калиевая) способны
разрушить комплексные соединения Zn
и вывести их в осадок. При
добавлении осадителя рН
обработанной воды меняется (рис. 1).
При этом выпадает осадок ZnSiO3,
вместе с ним соосаждается и СаSiO3,
т. к. Са2+ — ионы имеются в воде
оборотного цикла газоочистки
Zn2+ + SiO32-
= ZnSiO3,
Са2+ + SiO32- = СаSiO3.
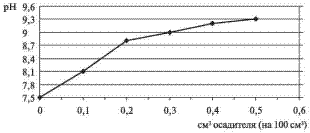
Рис. 1. Динамика изменения pH оборотной водлы при добавлении раствора силиката натрия
Этот факт можно использовать для контроля расхода реагента-осадителя. Важным фактором, влияющим на эффективность его применения, является скорость формирования осадка и легкость его отделения от жидкости. Большинство силикатов не относятся к веществам, легко формирующим хорошо отделяемые осадки. Тем не менее, в наших экспериментах была достигнута удовлетворительная скорость осаждения (рис. 2).
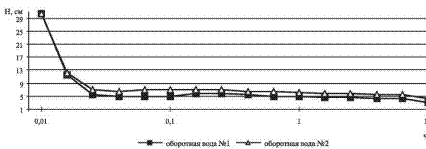
Рис. 2. Скорость осаждения силикатов из оборотной воды системы газоочистки
Чтобы получить
максимальную скорость осаждения
продуктов реакции с Na2SiO3,
необходимо, чтобы компоненты перед
смешиванием имели наибольшие
концентрации. Поскольку
концентрация Zn в оборотной воде
невелика, практически постоянна и
не поддается иным методам
регулирования, кроме осаждения,
следует использовать
концентрированные 10—20%-ные
растворы Na2SiO3. При
сильном разбавлении «жидкого
стекла» усиливается гидролиз
растворов. При рН < 10,9 растворы
неустойчивы и выделяют
кремнекислоту в виде геля тем
быстрее, чем ниже рН среды.
Для ускорения осветления следует
применять эффективные аппараты —
тонкослойные отстойники. После
завершения осадкообразования
оборотная вода имеет рН = 8—9 за счет
небольшого избытка Na2SiO3,
который легко гидролизуется,
формируя щелочную среду.
Остаточные количества силикатов
рекомендуется удалить при помощи
дополнительной ее нейтрализации до
рН = 6,5—7,5. Это можно сделать
добавкой небольшого количества
кислотных агентов, например,
сернокислотных отходов
травильного отделения, которые на
предприятии подвергаются
нейтрализации известью. При этом за
счет соосаждения с образующейся
нерастворимой кремнекислотой
удаляются все двухвалентные
катионы (Zn, Са и др.).
В табл. 3 приведены данные о
содержании Zn в оборотной воде до и
после обработки.
Таблица 3
Результаты анализов оборотной воды газоочистки на содержание цинка
Характеристика образца |
Исходная концентрация цинка в растворе, мг/дм3 |
Концентрация цинка после обработки карбонатом кальция, мг/дм3 |
Концентрация цинка после обработки силикатом натрия, мг/дм3 |
Образец оборотной воды № 1 |
12,6 |
0,9 |
0,14 |
Образец оборотной воды № 2 |
0,4 |
0,03 |
0,18 |
Как видно из табл. 3, Na2SiO3почти так же эффективен, как и Са(ОН)2, но скорость реакции в этом случае слишком мала, чтобы эффективно использовать его в реальных условиях. Поэтому в качестве реагента для осаждения выбран дешевый, доступный и эффективный Na2SiO3, остальные реагенты приняты в качестве запасных. Небольшие количества фосфат- или гидрофосфат-ионов могут быть введены для нейтрализации щелочности воды после силикатной обработки. Другой путь нейтрализации избытка силиката после силикатной обработки — обработка оборотной воды углекислым газом. Наиболее экономична повторная обработка отходящими газами, направляемыми на доочистку:
Na2SiO3 + CO2 = Na2CO3 + SiO2.
При этом будет
связана часть CO2 и SiO2,
что позволит получить
дополнительный экологический
эффект за счет улучшения очистки
отходящих газов от CO2 и SiO2.
Образующийся осадок кремнекислоты
отделяется в отстойниках совместно
с цинксодержащим осадком. При
осаждении он работает как
коллектор. Осадок используют как
сырье для выделения товарных
соединений Zn.
Для извлечения соединений цинка из
оборотной воды предлагается
следующая схема (рис. 3).
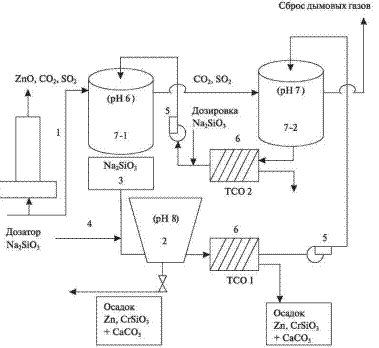
Рис. 3. Технологическая схема обработки оборотной воды систем газоочистки для выделения соединений цинка: 1 — отходящие газы систем газоочисток; 2 — радиальный отстойник; 3 — емкость для раствора силиката натрия; 4 — дозатор раствора силиката натрия; 5 — циркуляционные насосы; 6 — тонкослойный отстойник; 7 — система мокрой газоочистки
В соответствии с
предлагаемой схемой в оборотную
воду после пылеулавливания
дозируют реагент-осадитель из
емкости в количестве 0,001—0,01 м3/1000
м3 в сутки. После отстаивания
в радиальном отстойнике вода
дополнительно очищается в
тонкослойном отстойнике ТСО и
насосом подается на повторное
использование.
Для проведения опытно-промышленных
испытаний ведутся работы по выдаче
рабочего проекта установки и
монтажу оборудования, а также
врезка и подключение в
существующую систему циркуляции
оборотной воды дозатора для
раствора реагента.
Kasimov A. M., Alexandrov A. N.,
Leonova O. E., Ukrainian Scientific Research
Institute of Ecological Problems, Kharkov, Ukraine
Romanovskiy A. A., National Technical University «Kharkov
Polytechnic Institute», Kharkov, Ukraine Klimanchuk V. V., Irha
V. N., Mariupol Metallurgical Plant, Mariupol, Donetsk Region,
Ukraine
The paper presents new data collected
as a result of the pilot application of new options for the
removal of zinc compounds from gas treatment process water at the
metallurgical plant. This environmentally sound and
cost-effective technology is recommended for steel and iron
works.
Касимов Александр Меджитович, д. т. н., проф., зав. лабораторией систем и методов обращения с промышленными отходами и выбросами в атмосферу, Украинский научно-исследовательский институт экологических проблем, ул. Бакулина, 6, Харьков, 61166, Украина. Тел./факс (057) 702-07-37. E-mail: ecolab25dogniiep.kharkov.ua
Леонова Ольга Евгеньевна, аспирант, инженер-эколог, лаборатория систем и методов обращения с промышленными отходами и выбросами в атмосферу, Украинский научно-исследовательский институт экологических проблем, ул. Бакулина, 6, Харьков, 61166, Украина. Тел./факс (057) 702-07-37. E-mail: ecolab25dogniiep.kharkov.ua
Романовский Александр Александрович, м. н. с, Национальный технический университет «Харьковский политехнический институт», Фрунзе, 21, Харьков, 61002, Украина. Тел./факс (057) 707-68-87
© Независимое агентство экологической информации
Последние изменения внесены 24.04.07