Главная
страница
Сведения об авторах
ИССЛЕДОВАНИЕ ПРОЦЕССА ВОССТАНОВЛЕНИЯ ШЕСТИВАЛЕНТНОГО ХРОМА В ПРИСУТСТВИИ ДОБАВОК НИТРАТА МЕДИ И ЖЕЛЕЗА
Голоушкина В. В., Йилкал Вассихун Гошу, Царев Ю. В., Костров В. В., Ивановский государственный химико-технологический университет, Иваново, Россия
Шестивалентный хром
Cr(VI) используется в различных
промышленных процессах и может со
сточными водами попадать в
окружающую среду. Такие стоки
регулируются в промышленно
развитых странах, но установление
уровней нагрузки на окружающую
среду, разрешенной в данной
ситуации, часто требует обширного
моделирования и анализа риска.
Cr(VI) токсичен, он является сильным
окислителем и канцерогенным
веществом. Трехвалентная же
разновидность хрома Cr(III) токсична
при очень высоких концентрациях и в
определенных дозах даже необходима
в пище животных.
Целью настоящей работы было
изучение влияния температуры и
времени процесса восстановления
Cr(VI) до Cr(III) в присутствии добавок
Cu(NO3)2, Fe(NO3)3.
Для проведения эксперимента на
основе реактивов хромового
ангидрида CrO3 и бихромата
калия были приготовлены модельные
растворы сточной воды с
концентрацией Сr(VI) 100 мг/л. В
качестве восстановителя
использовали 5% раствор сульфита
натрия Na2SO3. Процесс
восстановления проводили в
присутствии добавок
десятипроцентных водных растворов
солей Cu(NO3)2, Fe(NO3)3,
вводимых в 100 мл модельного
раствора в количестве 2 мг. Для
определения содержания хрома Cr(VI) в
присутствии Cr(III) в модельный
сточной воде использовали
фотометрический метод . Этим
методом можно определить Сr(VI) с
концентрацией от 2 до 150 мг/л и
точностью ±0,6 %. Максимум
светопоглощения лежит в
ультрафиолетовой части спектра при
лямбда = 349 нм, молярный
коэффициент эпсилон =1500. Все
исследования были выполнены на
спектрофотометре Spekol-211 при лямбда
= 320 нм, спектральная ширина полос 15
нм и коэффициент усиления 200,
толщина кюветы 10 мм. Температура
всех исследуемых растворов
варьировалась в интервале от 20 °C до
80 °C, и ее поддержание
обеспечивалось с погрешностью ±0,5°C
термостатом UTU-4. Для измерения pH
модельных растворов использован
иономер И-130, где в качестве
стандартных были стеклянный и
хлорсеребряный электроды.
Процесс восстановления хрома
шестивалентного протекает по
следующим реакциям:
![]()
![]()
![]()
![]()
Концентрация ионов
водорода в нейтральной среде мала,
поэтому мы предложили вместо ионов
водорода использовать соли
металлов в качестве катализатора
для увеличения скорости
восстановления Cr(VI). Нами были
использованы водные растворы
нитрата меди Cu(NO3)2 и
железа Fe(NO3)3.
На рис. 1 представлены зависимости
степени восстановления хрома от
соотношения H2CrO4 : Na2SO3
(1 : 1, 1 : 3, 1 : 6, 1 : 10 и 1 : 15) при введении
солей металлов и без них.
Температура процесса — 80 °С,
продолжительность — 1 час.
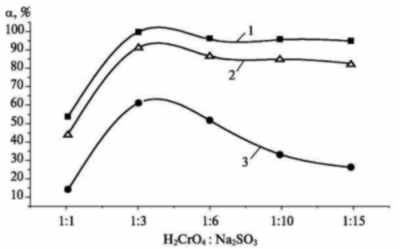
Рис. 1. Зависимости
степени восстановления Cr+6 от
соотношения H2CrO4 : Na2SO3
при t = 80 °C и продолжительности
процесса 1 ч:
1 — Cu(NO3)2; 2 — Fe(NO3)3;
3 — без катализатора
Из графика видно, что
добавка Cu(II) и Fe(III) позволяет
достичь более высоких степеней
восстановления Cr(VI) до Cr(III) для
соотношения хромовая кислота —
сульфит натрия 1 : 3.
Степень восстановления Cr(VI) до Cr (III)
увеличивается до 60% без добавления
гомогенного катализатора при
соотношении H2CrO4 : Na2SO3
= 1 : 3. При добавлении сульфита
натрия в три раза больше, чем по
стехиометрии, степень
восстановления Cr(VI) уменьшается
вследствие увеличения содержания в
растворе гидроксид-ионов. Это
снижает концентрацию ионов
водорода, которые играют в реакции
окисления-восстановления Cr(VI) роль
катализатора. В связи с этим резко
падает скорость процесса
восстановления и требуется большая
продолжительность времени
восстановления. Это отмечено
многими исследователями.
На рис. 2 представлены зависимости
степени восстановления
шестивалентного хрома от времени в
присутствии катионов Cu+2, Fe+3
и без них. Данные были получены для
соотношений H2CrO4 : Na2SO3
= 1 : 3.
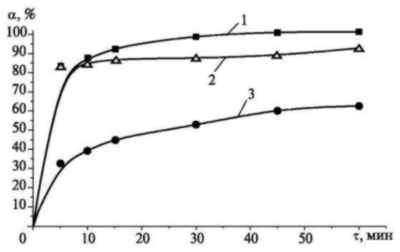
Рис. 2. Зависимости
степени восстановления Cr+6 от
времени при H2CrO4 : Na2SO3
= 1 : 3 и t = 80 °C:
1 — Cu(NO3)2; 2 — Fe(NO3)3;
3 — без катализатора
Как видно из рис. 2,
при использовании катализаторов
более 80% Cr(VI) восстанавливается в
течение 15 мин. По истечении часа
степени восстановления хрома
достигают 99,7% и 91,2% соответственно
при использовании Cu(NO3)2
и Fe(NO3)3.
На рис. 3 представлены зависимости
степени восстановления хрома от
соотношения K2Cr2O7 :
Na2SO3 (1 : 1, 1 : 3, 1 : 6, 1 : 10 и 1 :
15) при использовании добавок солей
металлов и температуре 80 °С в
течение одного часа протекания
реакции.
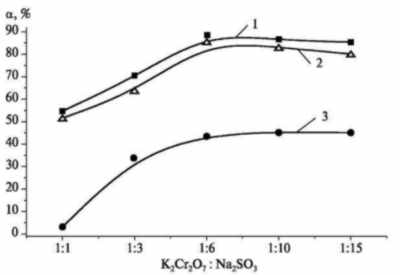
Рис. 3. Зависимости
степени восстановления Cr+6 от
соотношения K2Cr2O7 :
Na2SO3 при t = 80 °C и
продолжительности процесса 1 ч:
1 — Cu(NO3)2; 2 — Fe(NO3)3;
3 — без катализатора
Из графика видно, что
добавление Cu(II) и Fe(III) позволяет
достичь более высоких степеней
восстановления Cr(VI) до Cr(III) с
наилучшим соотношением K2Cr2O7
: Na2SO3 = 1 : 6.
На рис. 4 представлены зависимости
степени восстановления
шестивалентного хрома от времени в
присутствии катионов Cu+2, Fe+3
и без них при 80 °C. Данные были
получены для соотношения K2Cr2O7
: Na2SO3 = 1 : 6.
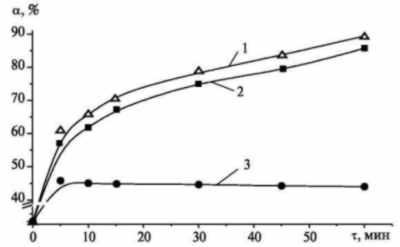
Рис. 4. Зависимости
степени восстановления Cr+6 от
времени при K2Cr2O7 :
Na2SO3 = 1 : 6 и t = 80 °C:
1 — Cu(NO3)2; 2 — Fe(NO3)3;
3 — без катализатора
При использовании
катализаторов более 60% Cr(VI)
восстанавливается в течение 15 мин.
По истечении часа степени
восстановления хрома достигают 89,4
и 85,7% соответственно в присутствии
катионов Cu+2 и Fe+3.
В ходе протекания процесса
восстановления шестивалентного
хрома происходило изменение рН
исследуемых модельных растворов,
что было вызвано отсутствием их
буферизации. Из уравнения (1) видно,
что реакция между сульфитом натрия
и хромовой кислотой при избытке
сульфита натрия может протекать в
обратном направлении. Высокое
значение рН сульфита натрия при
добавлении его избытка к раствору
приводило к тому, что степень
восстановления шестивалентного
хрома снижалась (см. рис. 1). Для
систем, в которые вводили добавки
солей металлов, скорость процесса
не лимитировалась содержанием
ионов водорода в растворе, так как
их функцию ускорения процесса
восстановления брали на себя
нитрат-ионы и ионы металлов меди (II)
и железа (III). На рис. 1 видно, что
увеличение дозы введенного
сульфита натрия для систем с солями
меди и железа не снижает степень
восстановления хрома (VI). В то же
время для систем с бихроматом калия
также не наблюдается снижения
степени восстановления хрома при
введении избытка сульфита натрия
(см. рис. 3). Это, возможно,
объясняется наличием в растворе
ионов калия, а также переходами
бихромат калия — хромат калия.
Начальный рН модельной сточной
воды равен для хромовой кислоты и
бихромата калия 5,3 и 5,8
соответственно. В ходе процесса
восстановления Cr(VI) до Cr(III) при
добавлении Na2SO3
конечное значение pH модельного
раствора увеличивается. Для систем
сульфит натрия — хромовая кислота
и сульфит натрия — бихромат калия
без добавок нитратов металлов
характерны более высокие значения
конечного рН раствора 6,5—7,0 и 7,5—8,5
соответственно, что связано с
наличием избытка сульфита натрия в
растворе, способствующего
увеличению рН. Анализ
экспериментальных данных
показывает, что степень
восстановления Cr(VI) в растворе
коррелирует с изменением pH. Этот
факт можно объяснить тем, что при
восстановлении по реакции (3) и (4)
каждого из бихромат-ионов
образуются ионы OH–, которые
поддерживают щелочную среду
раствора и стабилизируют исходное
содержание Cr(VI).
Для систем сульфит натрия —
хромовая кислота и сульфит натрия
— бихромат калия с добавками
нитрата меди не наблюдается
изменения конечного рН раствора от
температуры восстановления, а для
системы с нитратом железа
происходит некоторое снижение рН (с
4,5 до 3,0) при использовании
модельного раствора H2CrO4.
Выводы
В результате выполненной работы
для растворов хромовой кислоты и
бихромата калия с рН 7—8,5 был
предложен вариант ускорения
процесса восстановления
шестивалентного хрома сульфитом
натрия в растворе с помощью добавок
Cu(NO3)2, Fe(NO3)3.
Получены экспериментальные
значения конечных рН раствора и
степени восстановления хрома в
присутствии вышеуказанных добавок.
Эксперимент подтвердил
первоначальное предположение о
возможности ускорения процесса
восстановления хрома
шестивалентного с помощью
выбранных соединений.
Нитрат-ионы вносят наибольший
вклад в процесс восстановления
только при температурах 60—80 °С.
Ионы меди и железа играют важную
роль в ускорении восстановления
хрома во всем рассматриваемом
интервале температур.
Также следует отметить, что при
температуре 80 °С в бихроматных
растворах степень восстановления Cr
(VI) меньше, чем в растворах хромовой
кислоты, что, возможно, объясняется
значением водородного показателя
среды.
Goloushkina V. V., Yilkal Wassihun Goshu, Tsaryov Yu. V., Kostrov V. V., Ivanovo State University of Chemistry and Technology, Ivanovo, Russia
The purpose of this study is the
reduction process of Cr (VI) to Cr (III) in the presence of
additives (salts of copper and iron nitrates). A model wastewater
sample was used in the study with Cr(VI) concentration at 100
mg/l. In test solutions, the ratios were supported as follows: К2Cr2O7:
Na2SO3 = 1 : 6 and H2CrO4 :
Na2SO3 = 1 : 3; at the temperature of 80
°С. The study results indicate that the addition of metal
nitrates under neutral conditions causes an increase in the
intensity of chromium reduction process, with the rate of Cr(VI)
reduction being as high as 99,7% after one hour of reaction
process. The study also examined changes in the final pH levels
in the test solution under different process temperatures.
Йилкал
Вассихун Гошу, аспирант,
кафедра промышленной экологии,
Ивановский государственный
химико-технологический
университет, ул. Фридриха Энгельса,
7, Иваново, 153000, Россия. Тел. (4932) 30-73-46
(доб. 2-17), факс (4932) 41-79-95. Email
Царев Юрий Валерьевич,
канд. техн. наук, доц., кафедра
промышленной экологии, Ивановский
государственный
химико-технологический
университет, ул. Фридриха Энгельса,
7, Иваново, 153000, Россия. Тел. (4932) 30-73-46
(доб. 2-17), факс (4932) 41-79-95. E-mail
Костров Владимир Васильевич,
д-р техн. наук, проф., кафедра
промышленной экологии, Ивановский
государственный
химико-технологический
университет, ул. Фридриха Энгельса,
7, Иваново, 153000, Россия. Тел. (4932) 30-73-46
(доб. 2-17), факс (4932) 41-79-95
© Независимое агентство экологической информации
Последние изменения внесены 10.07.07