Главная
страница
Сведения об авторах
ИЗУЧЕНИЕ ПРОЦЕССА АДСОРБЦИИ ШЕСТИВАЛЕНТНОГО ХРОМА НА ОКСИДЕ ЖЕЛЕЗА
Йилкал Вассихун Гошу, Царев Ю. В., Костров В. В., Ивановский государственный химико-технологический университет, Иваново, Россия
Шестивалентный хром
присутствует в сточных водах,
образующихся в кожевенной
промышленности, горной
промышленности, и наносит
серьезный экологический ущерб
окружающей среде. Шестивалентный
хром Cr(VI) более токсичен, чем
трехвалентный, и является
канцерогеном.
Существует множество методов
обработки сточных вод с целью
удаления ионов хрома:
восстановление, ионный обмен,
электролиз, электрохимическое
осаждение, испарение, экстракция
растворителем, обратный осмос,
химическое осаждение и адсорбция.
Недостатки большинства этих
методов — высокие
эксплуатационные затраты или
необходимость удаления ила,
загрязненного тяжелыми металлами.
Много исследований направлено на
получение дешевых адсорбирующих
веществ наподобие активированного
угля.
Преимущества адсорбции на оксиде
железа Fe2O3 —
сравнительно большая
поглотительная способность, очень
короткое адсорбционное время,
легкое отделение от загрязняющей
примеси.
В этом исследовании с целью
удаления Cr(VI) из модельной сточной
воды, содержащей хромовую кислоту
или бихромат калия, использован гамма-Fe2O3.
Эксперименты проводили на
модельных растворах сточных вод с
концентрацией Сr(VI) 100 мг/л,
приготовленных на основе реактивов
хромового ангидрида CrO3,
которые в воде образуют хромовую
кислоту, а также бихромата калия. В
качестве адсорбента использовали
порошок оксида железа Fe2O3.
Процесс адсорбции проводили в
статических условиях при
перемешивании в течение 60 мин. Для
определения содержания Cr(VI) в
присутствии трехвалентного хрома
Cr(III) в модельный сточной воде
использовали фотометрический
метод. Этим методом можно
определить Сr(VI) с концентрацией от 2
до 150 мг/л и точностью ±0,6%.
Максимальное поглощение света
лежит в ультрафиолетовой части
спектра при лямбда = 349 нм,
молярный коэффициент эпсилон =
1 500. Все исследования были
выполнены на спектрофотометре
Spekol-211 при лямбда = 320 нм,
спектральная ширина полос — 15 нм и
коэффициент усиления — 200, толщина
кюветы — 10 мм.
Температура всех исследуемых
растворов поддерживалась на уровне
20 °C с погрешностью ±2 °C термостатом
UTU-4. Для измерения pH модельных
растворов использован иономер И-130,
где в качестве стандартных были
стеклянный и хлорсеребряный
электроды.
Внутренний комплекс сферы
взаимодействия между Cr (VI) и гамма-Fe2O3
представлен на рис. 1.
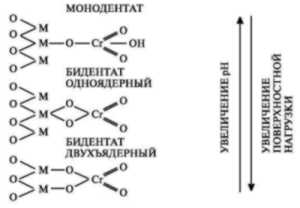
Рис. 1. Механизм процесса адсорбции шестивалентного хрома на поверхности оксида железа (III)
Процесс взаимодействия Fe2O3 c водой протекает по следующим реакциям:
Fe2O3(T) + 13H2O = 2Fe[(H2O)5 (OH)]2+ + 4OH– ; РПР25 = 59,39. (1)
Чтобы определить
степень адсорбции и установить
возможность использования этого
материала как адсорбирующего
агента, было исследовано
содержание Cr(VI) при различных
соотношениях Fe2O3, г /
раствор Н2CrO4 или K2Cr2O7,
мл.
На рис. 2 представлена зависимость
водородного показателя модельного
раствора сточной воды после
адсорбции хрома оксидом железа (III)
для соотношений оксид железа —
хромовая кислота (Fe2O3, г
/ раствор Н2CrO4, мл) от 0,2 :
10 до 3,2 : 10 и оксид железа — бихромат
калия (Fe2O3, г / раствор K2Cr2O7,
мл) от 0,2 : 10 до 3,2 : 10.
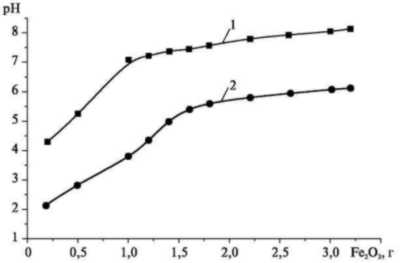
Рис. 2. Зависимости
конечного pH раствора от дозы Fe2O3:
1 — K2Cr2O7, 10 мл; 2 — Н2CrO4,
10 мл
Экспериментальные
данные показывают увеличение
конечных рН модельной сточной воды
по сравнению с начальным значением.
Конечный рН раствора с хромовой
кислотой достигает 2—6, а раствора с
бихроматом калия — 4—8, что связано
с протеканием процесса адсорбции
хрома на поверхности оксида железа
(III). На конечный рН раствора также
влиял процесс гидролиза,
протекавший в результате
взаимодействия оксида железа (III) с
водой по реакции (1).
Степень адсорбции Cr(VI) на Fe2O3
в мг/г вычисляли по следующей
формуле
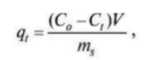 (2)
(2)
где Co,
и Ct —
концентрации шестивалентного
хрома соответственно в начале и
конце процесса адсорбции, мг/мл; V
— объем раствора, мл; ms
— масса оксида железа, г.
На рис. 3 и 4 представлены
зависимости степени адсорбции Cr(VI)
от времени при 20 °C соответственно
для модельных растворов H2CrO4
и K2Cr2O7.
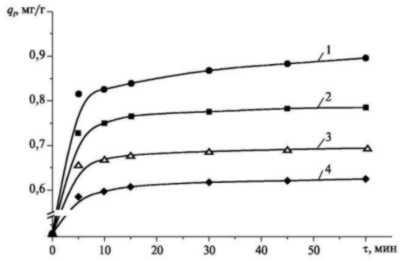
Рис. 3. Зависимость
степени адсорбции шестивалентного
хрома из раствора H2CrO4 от
времени при 20 °С:
1 - 1 г : 10 мл; 2 - 1,2 г : 10 мл; 3 - 1,4 г : 10 мл; 4
- 1,6 г : 10 мл
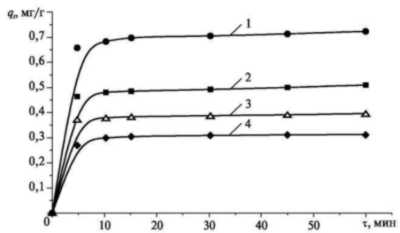
Рис. 4. Зависимость
степени адсорбции шестивалентного
хрома из раствора K2Cr2O7
от времени при 20 °С:
1 - 1 г : 10 мл; 2 - 1,8 г : 10 мл; 3 - 2,4 г : 10 мл; 4
- 3,2 г : 10 мл
Данные были получены
для различных соотношений Fe2O3:
H2CrO4 (1 г : 10 мл, 1,2 г : 10 мл,
1,4 г : 10 мл, 1,6 г : 10 мл) и соотношений Fe2O3:
K2Cr2O7 (1 г : 10 мл, 1,8 г
: 10 мл, 2,4 г : 10 мл, 3,2 г : 10 мл). Из
зависимостей видно, что степень
адсорбции Cr(VI) достигает 0,85 мг/г в
течение 15 минут для раствора
хромовой кислоты с соотношением 1 г
: 10 мл и 0,7 мг/г для раствора
бихромата калия с соотношением 1 г :
10 мл. После одного часа степени
адсорбции хрома достигают 0,9, 0,8, 0,7 и
0,63 мг/г для раствора хромовой
кислоты при сооответствующих
соотношениях Fe2O3 : H2CrO4
и 0,7, 0,5, 0,4 и 0,3 мг/г для раствора
бихромата калия при
соответствующих соотношениях Fe2O3
: K2Cr2O7. Степень
адсорбции на оксиде железа (III)
шестивалентного хрома из раствора
бихромата калия меньше, чем из
раствора хромовой кислоты. Это
объясняется различным рН раствора
бихромата калия и хромовой кислоты
(см. рис. 1 и 2), так как при низких рН
адсорбционная емкость оксида
трехвалентного железа выше, чем при
высоких рН. В проведенном
исследовании рН раствора не
поддерживался постоянным, поэтому
при увеличении дозы Fe2O3 увеличивался
и рН исследуемого раствора в
результате гидролиза Fe2O3.
Это приводило к уменьшению степени
адсорбции, что видно из рис. 3 и 4, где
рост дозы Fe2O3
сопровождается падением степени
адсорбции с 0,9 мг/г до 0,63 мг/г для
раствора хромового ангидрида и с 0,7
мг/г до 0,3 м/г для раствора бихромата
калия.
На рис. 5 представлена зависимость
степени извлечения хрома
шестивалентного Cr(VI) от дозы
введенного в раствор оксида железа
(III).
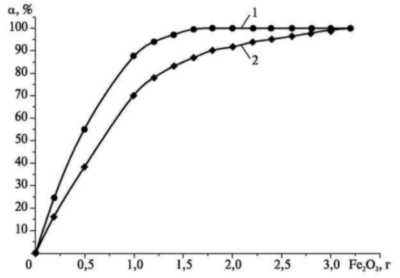
Рис. 5. Зависимость
степени извлечения Cr(VI) от дозы Fe2O3:
1 - Н2CrO4, 10 мл; 2 - K2Cr2O7,
10 мл
На основании данных
рис. 5 можно заключить, что дозы Fe2O3
1,5—2 г на 10 мл раствора хромового
ангидрида достаточно, чтобы
извлечь 98—99% шестивалентного хрома
из раствора. Для достижения
аналогичных результатов по степени
извлечения в случае бихромата
калия дозу Fe2O3
необходимо увеличить в 2 раза — до
3,0—3,5 г на 10 мл раствора.
Выводы
Выполненное исследование
позволило установить значительное
влияние рН раствора на степень
адсорбции шестивалентного хрома из
модельных растворов. Увеличение рН
уменьшает адсорбционную емкость
адсорбента, которым является Fe2O3.
Значительную роль в снижении
адсорбционной емкости играет сам
адсорбент, который гидролизуется,
увеличивая рН раствора. В ходе
исследований установлено, что для
модельных растворов хромового
ангидрида и бихромата калия
необходимая доза оксида железа (III)
составляет соответственно 1,5—2,0 г/10
мл раствора и 3—3,5 г/10 мл раствора.
Указанные дозы позволят извлечь до
98—99% шестивалентного хрома из
раствора в течение 1 часа при
температуре 20 °С.
STUDY INTO THE HEXAVALENT CHROMIUM ADSORPTION PROCESS BASED ON THE USE OF IRON OXIDE
Yilkal Wassihun Goshu, Tsaryov Yu. V., Kostrov V. V., Ivanovo State University of Chemistry and Technology, Ivanovo, Russia
The purpose of this study was to
examine the Cr(VI) adsorption process with the use of iron oxide
(Fe2O3) powder as an adsorbent.
Model wastewater sample with Cr(VI) concentration at 100 mg/l was
examined. The following concentration ratios were supported in
the solutions: iron oxide (Fe2O3, g) and
chromic acid (Н2CrO4, ml) from 0,2 : 10 to
3,2 : 10; and iron oxide (Fe2O3, g) and
potassium dichromate (K2Cr2O7,
ml) from 0,2 : 10 to 3,2 : 10, at the temperature of 20 °С.
The study results indicate that the addition of Fe2O3
and increase in pH levels cause an increase in Cr(VI) extraction
intensity to about 100% after one hour of reaction process.
Йилкал
Вассихун Гошу, аспирант,
кафедра промышленной экологии,
Ивановский государственный
химико-технологический
университет, ул. Фридриха Энгельса,
7, Иваново, 153000, Россия. Тел. (4932) 30-73-46
(доб. 2-17), факс (4932) 41-79-95. E-mail
Царев Юрий Валерьевич,
канд. техн. наук, доц., кафедра
промышленной экологии, Ивановский
государственный
химико-технологический
университет, ул. Фридриха Энгельса,
7, Иваново, 153000, Россия. Тел. (4932) 30-73-46
(доб. 2-17), факс (4932) 41-79-95. E-mail
Костров Владимир Васильевич,
д-р техн. наук, проф., кафедра
промышленной экологии, Ивановский
государственный
химико-технологический
университет, ул. Фридриха Энгельса,
7, Иваново, 153000, Россия. Тел. (4932) 30-73-46
(доб. 2-17), факс (4932) 41-79-95
© Независимое агентство экологической информации
Последние изменения внесены 12.07.07