Разработка приемов выделения белков из молочной сыворотки
Рытченкова О. В., Красноштанова А. А., Российский химико-технологический университет им. Д. И. Менделеева, Москва, Россия
Молочная сыворотка — побочный продукт производства сыра и творога — содержит ценные биологически активные компоненты: лактозу, белки, фосфолипиды, витамины и минералы. Белки молочной сыворотки (лактоглобулин, лактоальбумин, лактоферрин, лактопероксидаза) можно использовать в пищевой и фармацевтической промышленности. Они заметно снижают уровень холестерина в крови и выполняют защитные функции, в частности, лактоферрин обладает железосвязывающей способностью. Этот белок важен для развития новорожденных, поскольку предотвращает рост в организме Е. coli, стафилококков, Candida albicans и транспортирует необходимые для ребенка ионы железа. Иммуноглобулины обладают активностью антител против соответствующих антигенов.
В настоящее время около 50 % образующейся сыворотки (1,5—3 млн т в год) сливают в канализацию, что значительно ухудшает состояние окружающей среды и приводит к потере ценных продуктов.
Цель данного исследования — разработка приемов выделения белков из молочной сыворотки.
В экспериментах использовали молочную сыворотку с содержанием сухих веществ 5,9—6,0 % и белков 7 % по сухому веществу. Установлено, что концентрирование молочной сыворотки целесообразно проводить на полых волокнах, удерживающих вещества с молекулярной массой выше 15 кДа. В результате образуются 2 фракции: концентрат, обогащенный высокомолекулярными белками, и пермеат, обогащенный лактозой и минеральными веществами. Максимально возможная степень концентрирования равна 4, селективность по белковым веществам составляет 66—70 %. Таким образом, часть белков переходит в пермеат. Поэтому было изучено молекулярно-массовое распределение белковых веществ в концентрате и пермеате. Для этого использовали метод хроматографии на колонках, заполненных сефадексом с различными размерами пор. Полученные результаты представлены в табл. 1.
Таблица 1
Молекулярно-массовое распределение белковых веществ в концентрате и пермеате
|
Хроматография на колонке |
Молекулярный состав, кДа |
|
|
в концентрате |
в пермеате |
|
|
G-25 |
27—29 |
16; 24—29 |
|
G-50 |
7—8 |
9—11 |
|
G-75 |
13—14 (мало); 60 (много) |
11,9—І2,5; 24 (мало) |
|
G-200 |
75—80; 100 |
25—26 |
Анализ полученных данных показывает, что в концентрате присутствуют бычий сывороточный альбумин, лактопероксидаза и иммуноглобулины, а в пермеате — а-лактоальбумин, β-лактоглобулин. Молекулярные массы и изоэлектрические точки этих белков приведены в табл. 2.
Таблица 2
Характеристики важнейших белков молочной сыворотки
|
Белок |
Молекулярная масса, кДа |
Изоэлектрическая точка |
|
а-Лактоальбумин |
14,1 |
4,8 |
|
β-Лактоглобулин |
18,2 |
4,9—5,4 |
|
Бычий сывороточный альбумин |
66 |
4,8 |
|
Лактоферрин |
78—80 |
8,0—8,8 |
|
Лактопероксидаза |
78—80 |
8,6—9,6 |
|
Иммуноглобулины |
150—900 |
5,8—7,3 |
Поскольку ультрафильтрация не позволяет селективно разделить белки, был использован метод осаждения из водно-спиртового раствора (для повышения полноты осаждения). На рис. 1 показано влияние рН среды на степень осаждения.

Рис. 1. Зависимость от рН степени осаждения белковых веществ в концентрате
В исследуемом диапазоне рН наблюдается три пика: при рН 5, 6 и 9. Согласно литературным данным (см. табл. 2), рН 9 соответствует изоэлектрической точке лактоферрина и лактопероксидазы, рН 6 — иммуноглобулинам, рН 5 — лактоглобулину. Отсюда видно, что из концентрата целесообразно осадить иммуноглобулины и лактоферрин вместе с пероксидазой. Осаждать лактоглобулин не имеет смысла, поскольку его молекулярная масса составляет 18,2 кДа и содержание его в концентрате мало.
Белки последовательно осадили из концентрата, обработали спиртом и высушили на воздухе. Молекулярно-массовый состав полученных изолятов изучили с помощью метода гель-хроматографии на колонке, заполненной сефадексом
G-200. Полученные результаты представлены на рис. 2.На рис. 2а максимальному пику соответствуют имунноглобулины, на рис. 2б — лактоферрин.
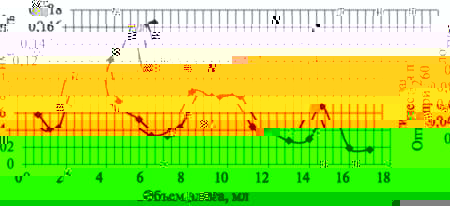
а

б
Рис. 2. Гель-хроматограмма белковой фракции, осажденной на сефадексе
G-200:а — рН = 6,0; б — рН = 9,0
Установлено, что содержание белка в изолятах составляет 35—50 %. Это свидетельствует об их загрязненности минеральными примесями и необходимости дополнительной очистки диафильтрацией или переосаждением. Изолят, полученный осаждением из концентрата при рН 9,0, содержит лактоферрин и лактопероксидазу.
Таким образом, получены два белковых образца, один из которых представляет собой смесь иммуноглобулинов, а другой — смесь лактоферрина и лактопероксидазы.
Development of Proteins Allocation Technique from Lactoserum
Rytchenkova O. V., Krasnoshtanova A. A., D. I. Mendeleyev University of Chemical Technology of Russia,Moscow, Russia
The ultrafiltration process of lactoserum and molecular weight distribution of proteins in a concentrate and permeate was researched. It was observed that the concentrate contains immunoglobulins, bovine whey albumin, lactoferrin, and lactoperoxidase, permeate contains a-lactalbumin and b-lactoglobulin. The precipitation process of proteins in isoelectric point was researched. Two protein samples are obtained: the first consists of immunoglobulins mixtures and the second is a mixture of lactoferrin and lactoperoxidase.